这些免疫组化IHC的常见问题,看看你踩坑了吗?
免疫组织化学又称免疫细胞化学, 是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项新技术。
良好的免疫组化染色切片是正确判断染色结果的基础和前提。由于免疫组化染色过程中存在很多步骤或环节,每一个步骤或环节都可能影响到染色的最终结果,因此,要做好一张高质量的免疫组化切片并不是一件非常容易的事。
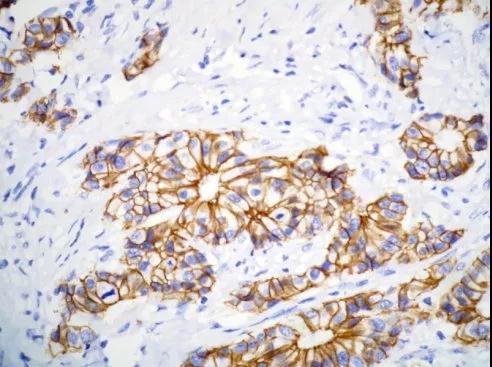
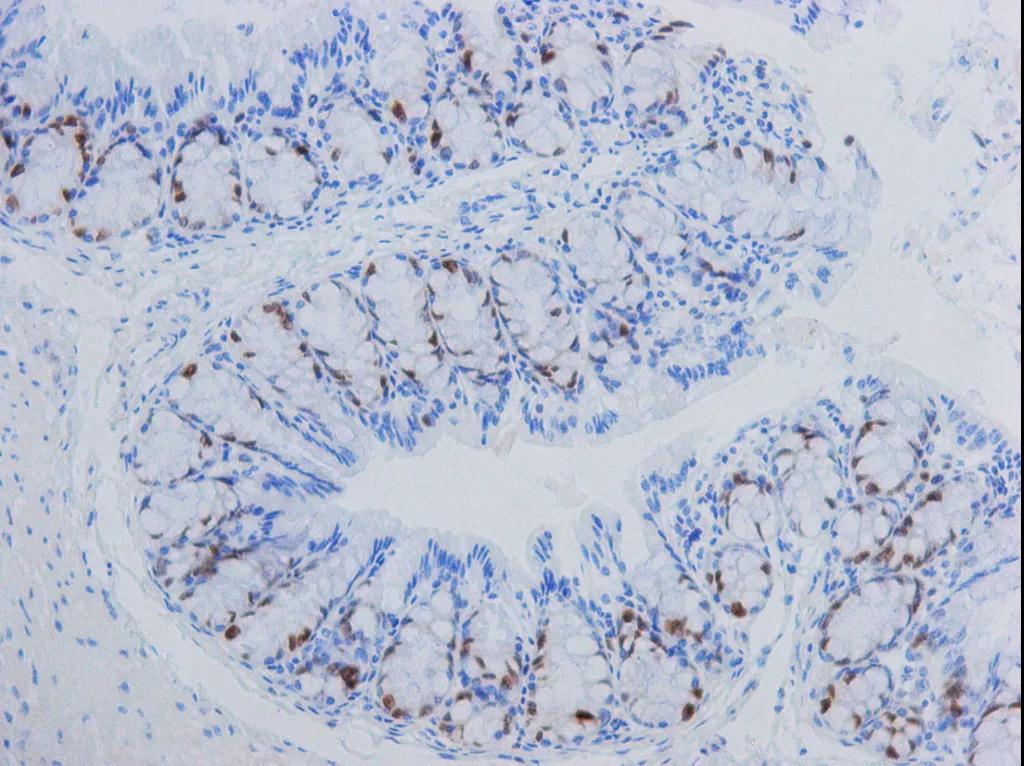
原因分析:
a.缓冲液内含叠氮化钠,抑制酶的活性;
b.染色未完全按照操作步骤进行;
c.漏加一种抗体或抗体失活;
d.复染或脱水剂使用不当;
e.底物中加入的过氧化氢少或失活。
解决措施:设立“阳性对照”。如果阳性对照有了表达,说明染色的全过程和所有试剂都没有问题。如果此时测试片仍为阴性,便是真实的阴性,说明组织或细胞没有相应的抗原表达。
原因分析:
a.缓冲液配置中未加氯化钠和PH值不准确,洗涤不彻底;
b.使用已变色的呈色第五溶液,或呈色反应时间过长;
c.过氧化氢浓度过高,呈色反应过快且粘附剂太厚;
d.切片在染色过程中抗体过浓,或干片了;
e.抗体孵育时间过长。
解决措施:缩短抗体孵育时间和呈色反应时长,染色过程中防止出现干片情况,同时增加阴性对照片,更有利于观察。
原因分析:
a.漂洗不够;
b.切片或涂片过厚;
c.蛋白质封闭不够或所用血清溶血
d.使用全血清抗体稀释不够;
e.底物成色反应过久;
解决措施:对一些新的或少用的抗体显色时进行监控,避免显色时间过长。
原因分析:
a.组织边缘与玻片粘贴不牢,边缘组织松脱漂浮在液体中,导致洗涤不彻底;
b.切片上滴加的试剂未充分覆盖组织,边缘的试剂容易首先变干,浓度较中心组织高而致染色深。
解决措施:组织的前期处理应规范,试剂要充分覆盖组织,尽量避免选用坏死较多的组织。
END
本文转自:细胞之邦
文章来源:生物服务
