抗体验证不充分导致论文撤回?细胞系可靠性需重视!
CRISPR 基因编辑技术自2012年问世以来就格外受关注,8年来,在众多顶尖研究人员相互启发以及白热化地竞争性研究和开发之下,如今既可以用于敲除基因(Knockout),敲入新基因(Knock in),碱基编辑/碱基突变,还可以用于调节基因表达(CRISPR 激活和干扰,CRISPRa/CRISPRi),条件性敲除,条件性表达等等——是研究领域最为炙手可热的研究利器之一。2020年诺贝尔奖花落 CRISPR 技术,充分肯定了这项生物技术领域的重大突破。
精准地敲除细胞/动物胚胎上的靶向基因,可以在缺失靶向蛋白的情况下分析信号通路运作和代谢异常,帮助深入了解靶蛋白发挥的作用,进而构建相应的细胞/动物模型,用以筛选治疗靶点或者药物。相比之前大热的 RNA 干扰,CRISPR 的彻底敲除在效率和可靠性上都更胜一筹,除了推动功能分析/验证、药物研发等领域的研究进展,对我们最常用的 Western Blot,免疫荧光等涉及抗体的实验也产生了特殊的影响。
01
想验证抗体的特异性?CRISPR KO 细胞!
2006年 EMBO Journal 的一篇论文确定了转录抑制因子甲基化 CpG 结合域蛋白(MBD1)的翻译后调控机制。直到2019 年,有研究证实该项研究使用的抗体并不特异——抗体并未与目标靶点 MBD1 结合,而是结合另一个蛋白 CPSF6,致使该论文被撤回。而引用该论文,与多年来使用该抗体的研究所受到的影响更是难以评估。
使用不表达目标蛋白的基因敲除 KO 细胞系作为真正的阴性对照,是确保抗体特异性的金标准。而市面上数十万计的抗体中,有不少过去因为技术限制而未能充分验证。抗体验证不充分是导致生命科学领域研究出现可重复性问题的根源之一。有研究指出 36% 以上的临床前研发实验因试剂无效(包括抗体)而失败,每年估计造成 170 多亿美元的损失。由于新的研究通常会以既往研究作基础,如果使用不可靠数据得出的研究结论来支持进一步研发,更会让多年的心血毁于一旦。
有了 CRISPR 技术,实验室能够相对容易地获得 KO 细胞系/细胞裂解物作为阴性对照,来充分验证抗体。加拿大蒙特利尔神经病学研究所的一项研究介绍过如何使用 CRISPR KO 细胞选择具有靶点特异性和功能性的抗体。研究人员为肌萎缩侧索硬化 (ALS) 疾病基因 C9ORF72 构建了一个 CRISPR-Cas9 KO 细胞系,利用该细胞系对 16 种市面上的 C9ORF72 抗体进行验证,发现只有一种抗体在免疫荧光中具有靶点特异性,还有两种抗体在其他应用中显示出靶点特异性 。更尴尬的是,引用率高的抗体不一定是经充分验证的抗体。因此,在实验中增加一个 KO 细胞阴性对照,就能避免出现这个问题。
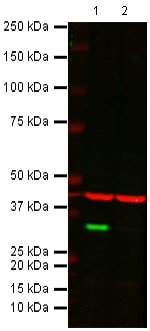
图1:Cdk4 抗体(ab108357)的 WB 结果。KO 样本中预期条带消失。
泳道1: 野生型 HAP1 细胞裂解液
泳道2:Cdk4 基因敲除 HAP1 细胞裂解液
检测抗体:Cdk4 兔单克隆抗体 [EPR4513] (ab108357),1/1000。
内参抗体(红色条带):β 肌动蛋白抗体 (ab8226),1/1000。
二抗:
IR 染料 800 山羊抗兔 IgG (H + L)
IR 染料 680 山羊抗小鼠 IgG (H + L)
均为 1/10,000 稀释
学术期刊对使用基因敲除细胞系验证研究成果以支持发表论文的呼声越来越高。但是,70% 以上的研究人员仍然没有在他们的实验中充分验证所使用的抗体——部分原因在于制备 CRISPR 基因敲除细胞系本身就已经需要几个月的时间,耗费精力过多。
02
建立 CRISPR KO 细胞系?心累!
CRISPR KO 细胞系对于验证抗体特异性的重要性毋庸置疑。除此之外,CRISPR KO 细胞系还有着广泛的应用。例如,研究蛋白质功能的基本策略之一就是研究分析缺乏目标蛋白的细胞特征信号通路的变化,这就需要用到对应靶标的基因敲除细胞系。再将缺失基因重新转入细胞,表达梯度丰度的目标蛋白以分析信号通路变化,深入了解研究科学问题。
但是建立 CRISPR 细胞系或模型并非一个简单的技术过程。全面完成一套 CRISPR 工作流程需要多次重复,花费数月的时间和大量精力。
使用 CRISPR 靶向目标基因区域时,需要一个向导 RNA 来引导 CRISPR-Cas9 复合物正确抵达靶标位置以进行编辑。正确选择合适的向导形式——单向导 RNA(sgRNA)、质粒还是慢病毒——需要了解待编辑的细胞类型、和有效转染的经验。设计出特异性向导序列,准确预测向导与基因组中序列的结合方式,都是提高编辑的成功率的重要因素之一。
另外,利用 CRISPR 技术对细胞的基因组进行编辑,实际可能还存在很多意外的不确定性——最近一篇在 Cell 上发表的文章表明,利用人类胚胎细胞对遗传性致盲的 EYS 突变基因进行基因编辑时意外发现 DNA 单次断裂导致一大段染色体丢失的情况——基因虽然敲除,但是细胞遗传背景发生了重大变化。全面验证的重要性不言而喻。
03
有快速解决方案么?有!
自己做,或定制,是当下多数实验室的选择。若是有现成的目录产品,可以像购买抗体一样购买已经过验证的 CRISPR KO 细胞系,不仅更值得信赖,更可以节省大量时间和精力。
为了提高现有抗体的特异性,同时为更多的科研工作者提供可靠的科研工具,Abcam 现提供针对数千种靶标的 CRISPR KO 细胞。它们是对常用的经典细胞系进行敲除,包括A549, HCT116, HEK-293T, HeLa, HEPG2, MCF7 等,经过 Sanger 测序(基因水平)验证,其中部分敲除细胞经过 WB(蛋白水平)验证。同时,免费提供 WT 细胞系对照。有了这些即用型敲除细胞系,科学家们就可以在课题之初快速验证科学假设,发文章补数据时节约大量时间,回答编辑质疑时迅速验证抗体的特应性了。
结语 …
CRISPR 技术本身在不断向更精确、更安全和适用范围更宽的方向迭代,而更多的科学家正在利用这强大的技术来验证其结果的准确性、深入探询基因功能和蛋白质的结构,不断拓展我们对生命科学领域的认知。
参考文献
1. Doench, J.G., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene. Nature. 2014
2. Doench, J.G., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature. 2016
