NRP1增强新冠病毒感染能力

NRP1与S1相互作用,增强SARS-CoV-2感染
NRP1感染路径的发现:
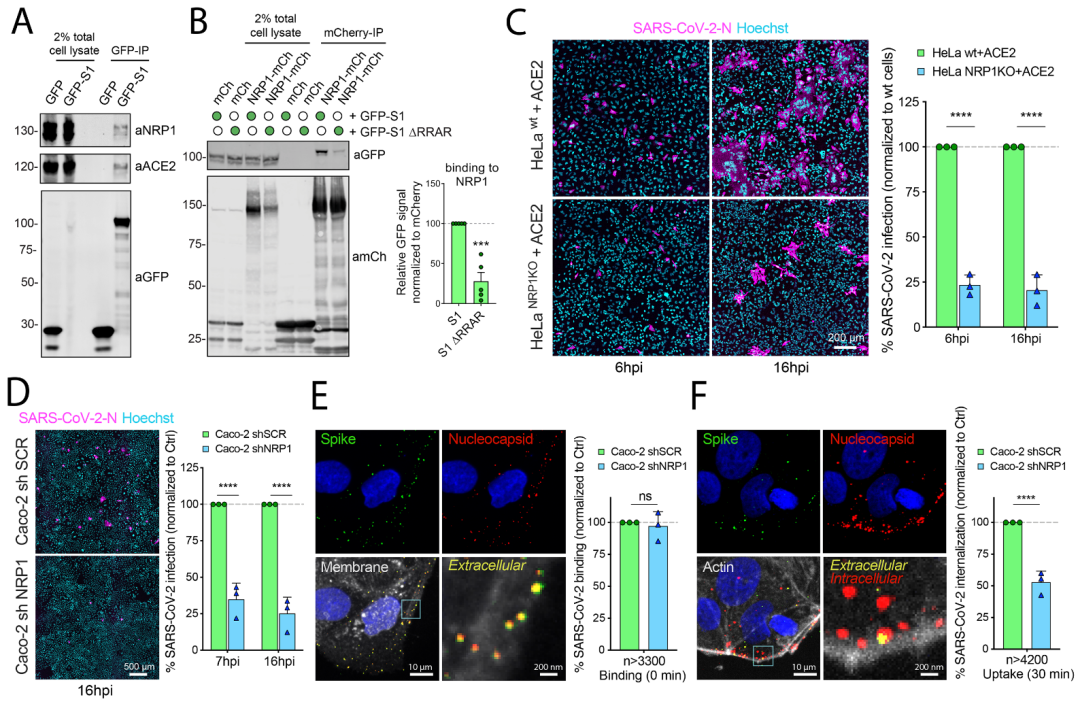
不同于新冠病毒的近亲SARS病毒,新冠病毒的S蛋白上具有弗林蛋白酶切割位点,因此,人体内的弗林蛋白酶因此可将S蛋白切割成S1和S2两个亚单位。研究者在观察SARS-CoV-2 S1序列时,发现其中一段序列与人类蛋白质中与NRP1相互作用的蛋白质序列极其相近。这让研究者提出了一个简单的假设:新冠病毒S1是否可以通过与NRP1结合,进一步帮助病毒感染人类细胞?之后通过应用一系列结构和生化方法,研究者确定了新冠病毒S1与NRP1结合。
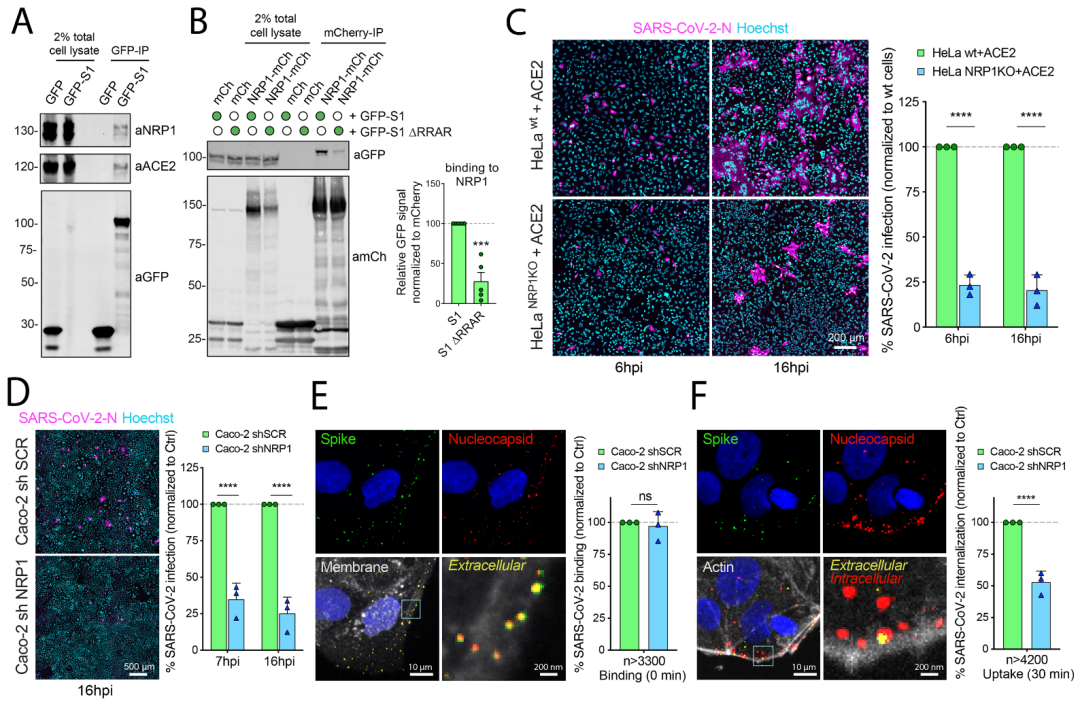
SARS-CoV-2 S1与NRP1 CendR结合的分子机制
NRP1的增强感染作用:
之后,研究者开始验证这种相互作用是否和新冠病毒感染相关。为了证明NRP1的参与,研究中使用不表达ACE2和NRP1的HEK-293T细胞,然后用两种质粒分别引入ACE2+TMPRSS2或者NRP1,并用新冠假病毒分别侵染这三种细胞。结果发现NRP1与S1蛋白结合显著增强了新冠病毒对于宿主细胞的感染力:在体外试验中,研究人员证明存在ACE2的情况下,NRP1可以促进病毒感染。如果该段氨基酸的序列被改变后,NRP1便失去了帮助增强新冠病毒感染的能力。
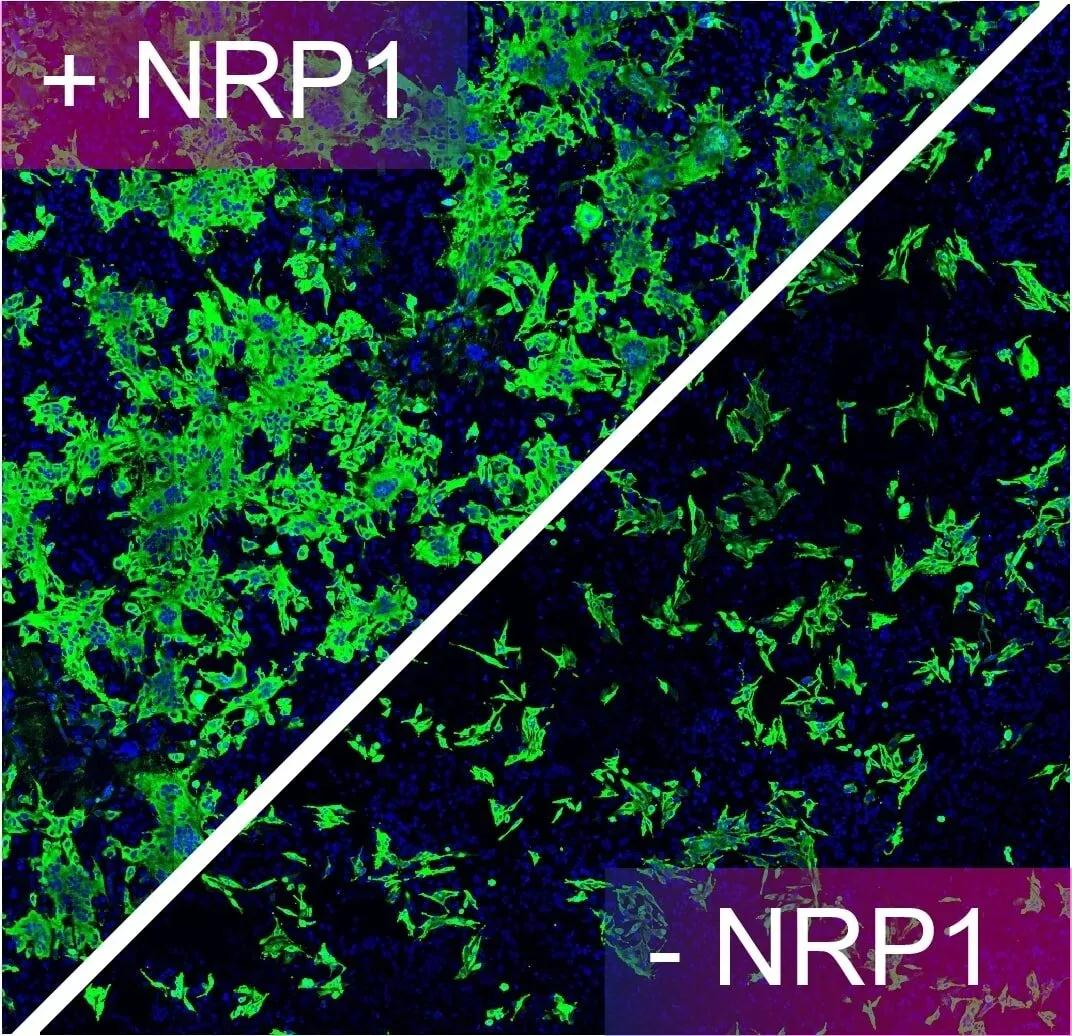
存在NRP1的情况下,感染病毒的细胞大大增加;阻断NRP1的情况下,感染病毒的细胞数量减少
在模拟病毒到达上呼吸道的实验中,科学家们构建了一种与新冠病毒形状和大小相同的合成纳米粒子,并在其表面偶联上能与NRP1结合的蛋白质。将纳米粒注入麻醉小鼠的鼻子后,两个小时后,纳米颗粒已经到达脑部,它首先出现在嗅球,并经由此处到达大脑皮层。
这表明病毒也能通过鼻子侵入人体,并且可能以嗅觉神经元为目标。这些神经元的祖细胞能够重建连接鼻子和大脑的轴突,因此这两个器官之间存在一条直接通道,也就可能被病毒利用。这也解释了为什么新冠病毒容易感染大脑。
NRP 1介导包覆有SARS-2 S衍生CendR肽的纳米颗粒进入小鼠细胞、嗅觉上皮细胞和中枢神经系统
之后,研究者通过用抗体特异性阻断NRP1,能够显著减少新冠病毒的感染。ACE2是病毒进入细胞的大门,那么NRP1可能是引导病毒进入细胞的另一个重要因素。ACE2在大多数细胞中表达水平很低,因此,病毒很难找到进入的大门,而其他因素如NRP1可能帮助病毒找到它入侵的大门。更重要的是,通过使用单克隆抗体或选择性药物,能够降低新冠病毒感染人类细胞的能力。这表明了NRP1在新冠靶点药物研究/治疗中的潜在价值。